Phylum : Amoebozoa

Texte © Prof. Giorgio Venturini

Traduction en français par Bianca Genson

Amoeba proteus en coloration vitale, avec le Rouge Neutre qui se concentre dans les lysosomes © G. Mazza
Amoeba proteus, Pallas 1766, est l’espèce la plus connue d’un genre de protiste auparavant compris dans le phylum des Rhizopoda, mais qui est actuellement, sur base de données moléculaires, classé dans le phylum des Amoebozoa, appartenant au règne des protistes. Nous devons cependant garder à l’esprit que la classification des protistes fait actuellement l’objet de beaucoup de débats.
La plupart des espèces vivent librement dans le sol, dans la boue ou dans l’eau, où elles se nourrissent de bactéries, de petits protistes et d’autres organismes unicellulaires ; seules quelques espèces sont parasites.
Amoeba proteus est l’espèce la mieux étudiée : c’est un organisme unicellulaire d’environ 250 microns (μm) de diamètre, pouvant même atteindre les 400-500 microns, capable d’émettre des extensions cytoplasmiques lobées, les pseudopodes, utilisés pour la locomotion et la capture des proies. Le genre Chaos, apparenté à Amoeba, comprend les plus grandes amibes connues, parmi lesquelles nous citerons Chaos carolinense qui peut atteindre 5 mm.
Observée sous le microscope, fraîche et sans coloration, l’amibe ressemble à une structure irrégulière, dépourvue de coloration et translucide, animée de mouvements continus qui consistent en un changement de forme, une émission de pseudopodes et un écoulement continu de matériel granulaire cytoplasmique. A l’intérieur, en plus de plusieurs granules, on observe un noyau et une grande vacuole ronde. Contrairement au genre Chaos dont les membres sont plurinucléaires, Amoeba proteus n’a qu’un noyau.
L’habitat de l’amibe consiste essentiellement en la boue du fond des mares d’eau douce, des lacs et des cours d’eau à faible débit, souvent sous la végétation aquatique, et aussi dans les sols très humides. Le nom du genre Amoeba, en français amibe, vient du grec “amoibé” (ἀμοιβή) = changement ; Proteus, dans la mythologie grecque, est le nom d’un dieu marin, aussi appelé le “Vieil Homme de la Mer”, capable de prendre la forme de n’importe quel animal ou plante, ou même d’objets tels l’eau ou le feu.
La plus ancienne description d’une amibe est due à August Johann Rösel von Rosenhof, un noble autrichien, peintre de miniatures, naturaliste et entomologiste, qui, en 1755, l’a baptisée “Der kleine Proteus” (“le petit Proteus”). Grâce à son habileté de peintre, ce savant nous a laissé de belles représentations de l’amibe et de nombreux autres organismes.
Historiquement, les microscopistes ont subdivisé le cytoplasme de l’amibe en deux parties ; un “ectoplasme” externe peu granulaire et en contact avec la membrane cellulaire, et un “endoplasme” interne granulaire dans lequel on peut distinguer une partie plus visqueuse, appelée plasmagel, et une moins visqueuse, appelée plasmasol. En fait, ces subdivisions reflètent différentes conditions fonctionnelles du cytoplasme et sont continuellement variables.
Locomotion
Pour comprendre la locomotion d’une amibe, nous pouvons penser à un pas humain, qui implique la projection vers l’avant d’une jambe suivie du contact du pied avec le sol. Le pied, maintenant bien placé sur le sol, sert d’ancrage pour tirer le corps vers l’avant grâce à la contraction des muscles de la hanche tandis que l’autre pied, qui était auparavant sur le sol, se soulève. Chez l’amibe, le principe est le même : projection vers l’avant d’un pseudopode, ancrage de celui-ci au substrat et traction du corps cellulaire vers l’avant, tandis que les précédents ancrages se détachent. Nous devons maintenant comprendre comment se forme un pseudopode, comment il s’allonge et s’ancre au substrat et comment se produit la traction vers l’avant du corps cellulaire.
Afin d’expliquer les mouvements de l’amibe et d’autres cellules dotées de mouvements amiboïdes, diverses théories ont été proposées au cours du temps, qui évoquent habituellement les changements de consistance des différentes parties du cytoplasme qui passent alternativement d’un statut de sol (colloïde) à un de gel (c’est-à-dire de liquide à gélatineux et vice versa), permettant une sorte de pressage du cytoplasme vers l’avant dans le sens de l’avancement. Dans ces théories, ne sont pas clairement identifiés les mécanismes causant ces changements de viscosité, comment ils sont dirigés, comment réellement ils génèrent un mouvement et quelles sont les sources d’énergie pour accomplir ce travail.
Plus récemment, on a examiné le rôle de certaines protéines présentes dans le cytoplasme de l’amibe et bien connues dans les organismes pluricellulaires, qui forment un véritable squelette intracellulaire vraiment flexible (cytosquelette), capable de s’allonger et de raccourcir activement en plus d’agir comme des pistes où peuvent se déplacer d’autres protéines, véritables moteurs moléculaires capables, à leur tour, de tirer d’autres filaments protéiques. Ces protéines cytosquelettiques et les moteurs moléculaires connexes se trouvent également à la base des mouvements de nos muscles.
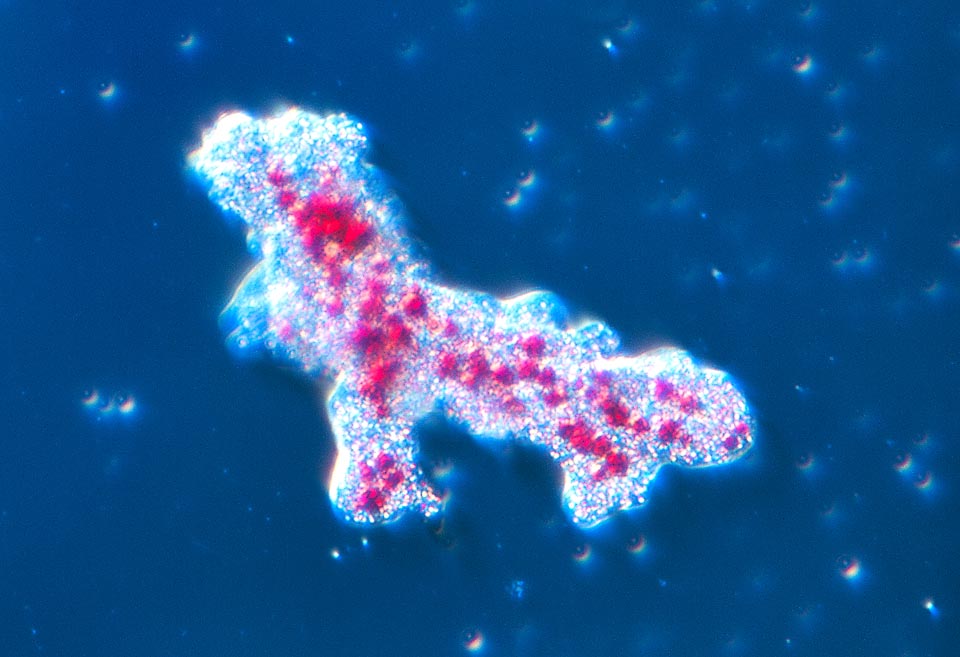
L’habitat de l’amibe consiste principalement en la boue du fond des mares d’eau douce, des lacs et des cours d’eau à faible débit dans le monde entier © Giuseppe Mazza
Nous essayons ici de tracer un mécanisme possible (qui n’exclut cependant pas l’intervention potentielle d’autres phénomènes). La protéine principale formant les filaments cytosquelettiques est appelée actine et est une molécule approximativement globulaire, abondante dans le cytoplasme de l’amibe ainsi que dans nos cellules. Les molécules d’actine peuvent se rejoindre de façon réversible pour former un filament, comme une sorte de collier de perles, qui peut s’allonger ou se raccourcir par addition ou soustraction de molécules globulaires. On pense que la protrusion des pseudopodes peut être au moins en partie générée par l’allongement des filaments d’actine qui, fusionnant en faisceaux parallèles, pousseraient vers l’avant la membrane.
En plus ou comme alternative à cette explication a été invoqué un rôle de l’actine et des protéines motrices associées, dans la production d’une force contractile capable d’induire un pressage de flux du cytoplasme vers l’avant. De même, le changement de la consistance du cytoplasme d’un état plus liquide à un état plus solide est la conséquence de l’agrégation des molécules d’actine. D’autres protéines interagissent avec l’actine formant des liaisons croisées entre les filaments et générant par conséquent une grille tridimensionnelle.
Pour une meilleure compréhension de ce phénomène, on peut penser à ce qui se passe quand le bouillon de viande se refroidit et se transforme en gelée : les molécules protéiques du collagène, séparées les unes des autres dans le bouillon bouillant, se rapprochent pour former des filaments qui créent une grille tridimensionnelle qui durcit la gelée. Dans l’exemple de la gelée, il se forme un réseau de filaments orientés de façon aléatoire, tandis que dans nos tissus, grâce à l’intervention des cellules, le collagène se rassemble pour former des bandes parallèles robustes, les tendons. Lorsque le pseudopode s’est allongé, certaines protéines de la membrane forment des ancrages au substrat.
Quels sont les facteurs qui stimulent la formation des filaments d’actine ? Qu’est-ce qu’“antérieur” ou “postérieur” pour une amibe ? Nous savons que les amibes sont sensibles aux signaux présents dans l’environnement (tropismes positifs ou négatifs). Par exemple, elles sont attirées par des molécules libérées par des sources de nourriture : ces molécules se lient aux protéines réceptrices présentes sur la membrane de l’amibe et activent une réponse moléculaire qui stimule l’agrégation de l’actine globulaire pour former les filaments. Il est intéressant de noter que les molécules stimulant l’agrégation de l’actine dans l’amibe sont les mêmes qui effectuent la même tâche dans nos globules blancs ou dans beaucoup d’autres cellules mobiles. C’est donc le signal chimique provenant de l’environnement qui stimule la protrusion des pseudopodes et qui détermine ce qui sera le pôle antérieur de la cellule. Lorsque le signal disparaît, les pseudopodes arrêtent de s’allonger dans cette direction puisque les filaments d’actine se désagrègent. L’étape suivante nécessite la traction ou la poussée du corps cellulaire dans la direction du pseudopode : ici entrent en jeu les protéines motrices (myosines) qui, tels de vrais moteurs moléculaires, “marchent” sur les filaments d’actine et déterminent le mouvement des échafaudages cytosquelettiques du cytoplasme dans la direction de l’extrémité qui avance, tandis que les anciens ancrages protéiques se détachent du substrat.
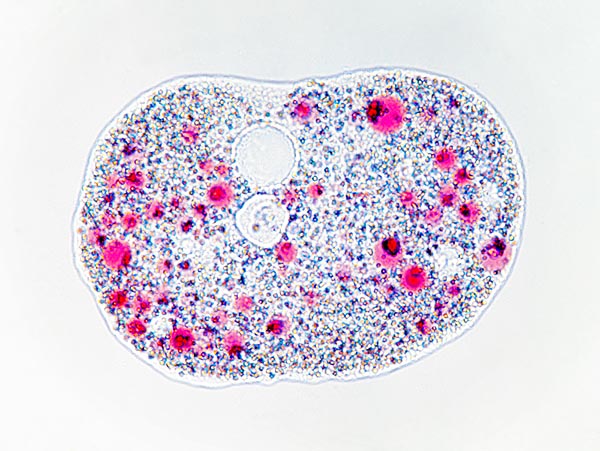
Amoeba proteus au repos. Au centre, en haut, on remarque la vacuole © Giuseppe Mazza
Cette interaction entre l’actine et les myosines est similaire à celle qui opère dans nos muscles. Bien entendu, l’allongement des filaments par apposition de nouvelles sous-unités ainsi que l’activité des moteurs moléculaires comme la myosine nécessitent une énergie qui est fournie, comme pour la plupart des phénomènes cellulaires nécessitant de l’énergie, par la molécule bien connue d’ATP, riche en énergie, continuellement produite par le métabolisme des cellules. Des fragments de cytoplasme isolés du corps cellulaire montrent également des mouvements en présence d’ATP. Une confirmation du rôle essentiel des filaments d’actine dans la locomotion de l’amibe provient d’expériences où les amibes ont reçu une substance (cytochalasine) qui empêche la formation des filaments d’actine. Dans ces conditions, l’amibe n’est plus capable de former des pseudopodes et de se déplacer.
Il est fascinant que les mêmes mécanismes moléculaires interviennent dans les mouvements de l’amibe, dans nos globules blancs ou dans nos muscles : on peut expliquer ces similitudes en réfléchissant au fait que les mécanismes du mouvement cellulaire ont évolué chez l’ancêtre lointain qui, il y a un milliard d’années environ, a créé la lignée évolutive des protozoaires qui conduira aux êtres humains. Donc, l’actine de l’amibe est la même que l’humaine ? Sûrement pas identique, vu que l’actine de l’ancêtre commun a subi des changements évolutifs cumulatifs (mutations) sur près d’un milliard d’années, évoluant vers l’actine de l’amibe moderne ou vers celle de l’homme moderne, mais ses caractéristiques fonctionnelles fondamentales sont restées les mêmes.
Nutrition
L’amibe est un organisme prédateur qui se nourrit en engloutissant par phagocytose d’autres protistes ou bactéries. Le phénomène est rendu possible par sa capacité à percevoir la présence des proies grâce à des signaux chimiques ou de contact et principalement d’émettre des pseudopodes au moyen desquels elle entoure le microorganisme et l’englobe dans une vésicule membranaire (vacuole de phagocytose ou phagosome). En réalité, pour une représentation plus précise du phénomène nous devons garder à l’esprit sa tridimensionnalité et penser en ce cas aux pseudopodes comme des lèvres qui se referment autour de la proie pour l’insérer dans la “bouche”, c’est-à-dire dans le phagosome.
Il est intuitif que la membrane entourant le phagosome vient de la membrane cellulaire et donc chaque phagocytose soustrait du matériel à l’involucre. Si l’on considère qu’une amibe, en un jour, réalise probablement une moyenne de 100 endocytoses, dans chacune desquelles elle internalise environ 10% de sa propre surface de membrane, on peut calculer que chaque jour est soustrait l’équivalent de 10 surfaces cellulaires. Ceci est rendu possible par des phénomènes concomitants d’exocytose qui ramènent à la surface la membrane des vieux phagosomes ou de la membrane nouvellement formée.
Pour bien comprendre ce recyclage continu des membranes dans une cellule et le transfert du contenu des vésicules, il faut penser que la membrane est un film fluide et que le comportement d’une cellule et de ses systèmes de vésicules peut être comparé à celui de gouttes d’huile mises dans un plat rempli d’eau : les gouttes peuvent fusionner en unissant leur contenu ou se diviser pour ensuite fusionner à nouveau. De la même manière, des vésicules prêtent à fusionner à nouveau peuvent se détacher de la membrane cellulaire, transférant leur contenu et leur membrane dans un échange continu.
Le matériel phagocyté est maintenant envoyé à la digestion par fusion du phagosome avec d’autres vésicules membranaires contenant des enzymes digestives, fonctionnellement équivalentes à celles présentes dans notre système digestif. Comme ces enzymes ne fonctionnent correctement que dans un environnement très acide, certaines pompes moléculaires présentes sur la membrane du phagosome transportent activement des ions hydrogène à l’intérieur de la vésicule (l’acidité correspond à une forte concentration d’ions hydrogène). La vésicule résultante, acide et contenant le matériel phagocyté et les enzymes digestives, prend le nom de lysosome et réalise la fonction de l’appareil digestif cellulaire.
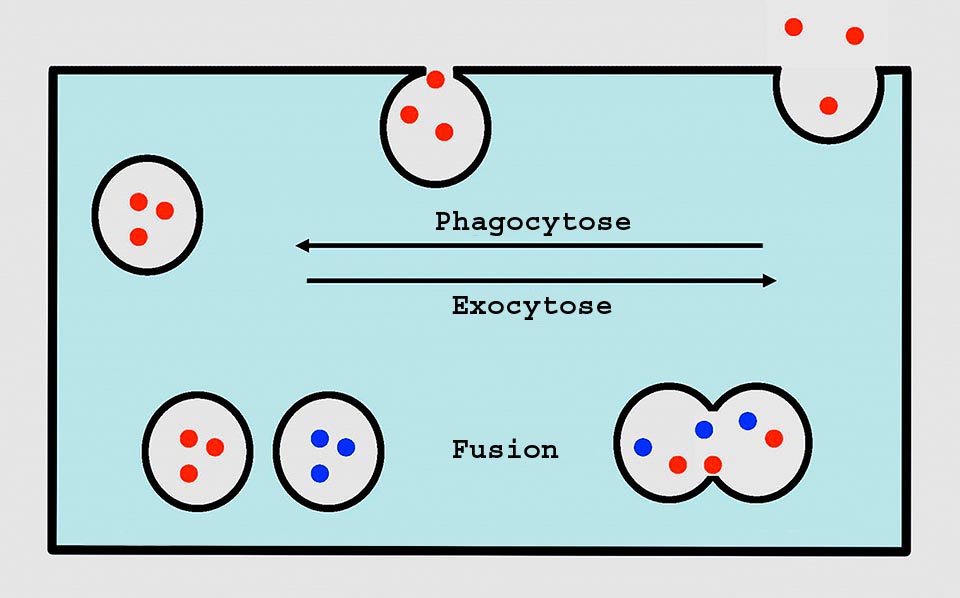
Chez l’amibe, la membrane, avec la phagocytose, produit une vésicule qui fusionne avec le lysosome. Après la digestion, les déchets sont expulsés par exocytose qui rend également à la membrane la surface soustraite par phagocytose. La vacuole contractile expulse aussi son contenu par exocytose
Lorsque les enzymes auront achevé leur action, le lysosome contiendra du matériel digéré, utile pour l’amibe, outre les déchets et le matériel non digéré. A ce stade, les protéines transporteuses présentes dans la membrane du lysosome transfèrent dans le cytoplasme les substances utiles (par exemple, des sucres ou des acides aminés provenant de la digestion), tandis que le lysosome se rapproche de la membrane cellulaire et fusionne avec elle, rejetant les déchets. Quoi qu’il en soit, il ne se produit jamais la rupture du lysosome et le versement de tout son contenu dans le cytoplasme : si cela se produisait, la cellule s’auto-digérerait !
La comparaison avec notre alimentation est facile : les aliments ingérés sont digérés par les enzymes de l’estomac et de l’intestin, les substances utiles obtenues par la digestion sont absorbées par la paroi intestinale et transférées au sang et les déchets sont expulsés avec les selles. La rupture de la paroi intestinale et de l’estomac (perforation) ont des conséquences extrêmement graves.
Alors que la phagocytose permet à l’amibe d’incorporer des structures volumineuses telles que des bactéries ou des protistes, cet organisme peut obtenir des nutriments de l’environnement par un processus appelé pinocytose (du grec “πινω” (pino), signifiant “je bois”), qui est en tout cas basé sur des principes semblables aux phagocytoses, puisqu’il permet d’insérer dans les vésicules membranaires de l’eau et des solutés macromoléculaires qui seront ensuite dirigés vers le lysosome.
Il faut enfin rappeler que la membrane cellulaire de l’amibe possède des mécanismes sophistiqués de perméabilité sélective qui permettent le passage de molécules simples de petite taille, comme les sucres, de l’extérieur vers le cytoplasme, sans formation de vésicules.
La vacuole contractile et la régulation de l’eau
Vivant dans des milieux d’eau douce, l’amibe, pour pouvoir survivre, doit faire face au problème de la régulation de son propre contenu en eau. En fait, le cytoplasme peut être considéré comme une solution très concentrée de substances organiques (comme par exemple des protéines ou des sucres) et inorganiques, séparées, grâce à la membrane cellulaire, d’un environnement aqueux à faible concentration de solutés, et donc plus riche en eau. La membrane cellulaire étant perméable à l’eau, la forte concentration intérieure de solutés attire l’eau vers l’intérieur par effet osmotique. Le résultat inévitable, en l’absence de mécanismes de régulation, devrait être celui du gonflement de la cellule et éventuellement de sa lyse (rupture).
L’amibe peut faire face à ce problème grâce à un organite cellulaire, la vacuole dite contractile, une vésicule membraneuse qui stocke de l’eau en excès, puis l’expulse hors de la cellule. Le mécanisme par lequel la vacuole peut accumuler l’eau a longtemps été obscur, son explication récente a permis de dévoiler également d’autres fonctions de cette structure.
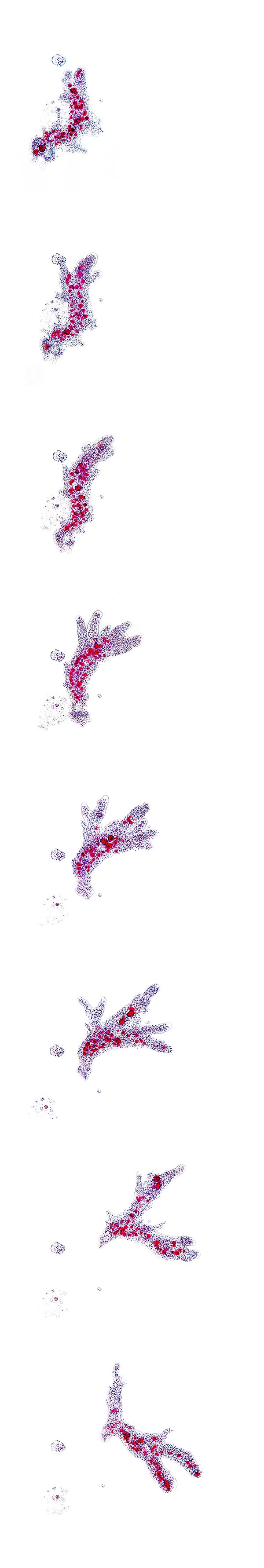
Séquence de mouvement d’Amoeba proteus © Giuseppe Mazza
La membrane de la vacuole est équipée de canaux perméables à l’eau et de pompes moléculaires capables de transporter activement en son sein diverses substances parmi lesquelles principalement des ions hydrogène (protons). Grâce à ce pompage de protons, l’intérieur de la vacuole a une très forte concentration en ions qui, par effet osmotique, attire l’eau du cytoplasme. De cette manière, l’eau qui est entrée dans la cellule par l’action osmotique du cytoplasme, s’accumule par effet osmotique dans la vacuole (si l’on considère le gradient de concentration des solutés, cela résulte en une valeur minimale dans l’environnement extérieur, intermédiaire dans le cytoplasme et maximale dans la vacuole ; d’où l’eau se déplace de l’extérieur au cytoplasme et de celui-ci à la vacuole).
A ce stade, la vacuole se déplace pour entrer en contact avec la membrane cellulaire et s’ouvre vers l’extérieur en déversant son contenu d’eau et de solutés. En fait, sur la membrane de la vacuole sont présents, outre les pompes pour les ions hydrogène, d’autres transporteurs qui accumulent diverses substances, comme par exemple des déchets métaboliques comme le dioxyde de carbone, l’urée ou l’acide urique, qui seront expulsés à l’extérieur lorsque la vacuole verse son contenu hors de la cellule. En conséquence, la vacuole n’agit pas seulement comme organite régulateur du contenu d’eau mais aussi comme organite excréteur qui élimine les déchets du métabolisme. L’expulsion du contenu de la vacuole implique que sa membrane fusionne avec la membrane cellulaire et donc, à ce point, la vacuole disparaît : une nouvelle se forme “ex novo” par la production d’une nouvelle vésicule.
Évidemment, le transport d’ions hydrogène et d’autres substances à l’intérieur de la vacuole nécessite de l’énergie, et cela est fourni par la molécule d’ATP. Le terme vacuole contractile induit une capacité à se contracter activement, suggérée par les observations des microscopistes qui avaient noté ses changements périodiques de volume. En fait, il semble que ces changements soient principalement dus à l’accumulation d’eau et non aux phénomènes de contraction active. Dans les amibes vivant dans l’eau de mer, qui n’ont pas le problème du gonflement vu que l’eau de mer a une concentration saline plus élevée que celle du cytoplasme, la vacuole n’existe pas (ces amibes auront, inversement, le problème opposé de la déshydratation).
Génétique et reproduction
Comme dans le cas d’autres amibes géantes, Amoeba proteus possède également dans son noyau un grand nombre de chromosomes, environ 250 paires, et une énorme quantité d’ADN, estimée à environ 290 milliards de bases (chez l’être humain, nous avons 23 paires de chromosomes et 3 milliards de bases). Les valeurs très élevées trouvées chez Amoeba proteus proviennent de phénomènes de polyploïdie, c’est-à-dire que les chromosomes se sont dupliqués plusieurs fois en paires identiques. Les chiffres cités sont en outre variables pendant le cycle vital du protozoaire. Les significations fonctionnelles de ces phénomènes ne sont pas claires.
Reproduction
La reproduction d’ Amoeba proteus est un processus périodique qui se répète à des intervalles qui dépendent du taux d’accroissement. Une amibe commencera à se diviser quand elle atteindra une taille suffisante, par exemple 0,2-0,3 mm. La reproduction est asexuée et se produit généralement par fission binaire. Avant de se diviser, la cellule rétracte ses pseudopodes et prend une forme arrondie. Se produit alors une division mitotique nucléaire suivie de la subdivision du cytoplasme qui se produit grâce à un sillon de clivage (dû aux mêmes protéines contractiles agissant dans la locomotion) suivie par l’activité des pseudopodes qui tirent dans des directions opposées les deux cellules filles. Le processus dure habituellement de 30 à 60 minutes.
Des phénomènes de fission multiple ont été décrits, qui se produisent dans des conditions défavorables de mauvaise alimentation ou de déshydratation : l’amibe s’arrondi et se recouvre d’un kyste résistant et imperméable qui lui permet de survivre jusqu’à ce que les conditions deviennent favorables. À ce stade, une division nucléaire multiple produit de nombreux noyaux qui se rassemblent à la périphérie de la cellule et finalement se séparent en de nombreuses nouvelles cellules qui sortent lorsque le kyste s’hydrate et éclate. L’enkystement semble se produire aussi indépendamment de la multiplication et représente donc un système pour surmonter des périodes de conditions défavorables, telles que l’assèchement du bassin d’eau. Certains microscopistes ont décrit des phénomènes qui conduisent à penser à une conjugaison, mais le sens de ces observations n’est pas clair.
Symbiose et parasitisme
Même si Ameba proteus est capable de phagocyter et digérer la plupart des bactéries, il existe au moins une espèce de bactérie, semblable à Legionella, l’agent pathogène de la légionellose, capable de survivre à l’intérieur du phagosome, évitant la digestion. Cette bactérie établit une relation symbiotique avec l’amibe qui induit dans les deux espèces des changements qui les rendent mutuellement dépendantes. Chez certaines espèces d’amibes, on a trouvé des infections par des virus caractérisés par des dimensions exceptionnellement importantes, comme le Mimivirus ou le Pandoravirus. Ces virus ont des diamètres compris entre 400 et 1000 nanomètres (nm, milliardièmes de mètres) et leur ADN s’élève à un ou deux millions de bases. Nous considérons que la plupart des virus ont des dimensions de quelques dizaines de nm et que leur ADN a quelques dizaines de milliers de bases.
Les prédateurs de l’amibe
Les amibes sont des proies pour divers organismes, dont les nématodes, les petits poissons, les crustacés et les mollusques, dont elles peuvent se défendre en sécrétant des substances toxiques ou répulsives.
Les amibes pathogènes pour l’être humain
La pathogénicité des amibes n’est pas complètement claire, puisque seules quelques souches des espèces potentiellement concernées sont pathogènes pour l’homme et que, dans la plupart des cas, elles perdent facilement leur caractère infectieux.
Les genres les plus importants sont Naegleria et Balamuthia, qui peuvent causer une encéphalite grave, Acanthamoeba, cause de méningo-encéphalite et de kératite, ou Hartmannella, cause de kératite. En plus de cela, il faut rappeler que certaines amibes peuvent être infectées par des bactéries pathogènes pour l’homme et agir ensuite comme vecteurs de maladie.
Sûrement, l’espèce pathogène la plus importante est cependant Entamoeba histolytica, agent de l’amibiase intestinale, une infection intestinale qui peut être extrêmement grave, avec même des complications fatales. On estime que 50 millions de personnes dans le monde sont infectées par cette amibe, en particulier dans les pays tropicaux, avec 50000-100000 décès par an. Dans la plupart des cas, l’infection est asymptomatique, mais dans environ 10% des cas elle provoque des formes de dysenterie.
Les amibes envahissent la muqueuse intestinale et détruisent ses cellules, produisant des ulcérations, avec perte de sang qui peut causer une anémie sévère et des perforations possibles avec des résultats extrêmement graves. Les ulcérations peuvent permettre aux protozoaires d’atteindre le flux sanguin et donc d’être transportés dans des organes tels que le foie ou le cerveau, provoquant des abcès très graves, voire mortels. Quand elles atteignent le côlon, en raison de la déshydratation progressive du contenu intestinal, les amibes produisent un kyste qui sera expulsé avec les selles et qui représente la forme capable d’infecter d’autres individus. Le kyste mature a quatre noyaux et, à juste titre, sa recherche microscopique dans les selles représente la méthode de diagnostic classique. Le kyste est extrêmement résistant et peut survivre longtemps dans l’eau ou dans le sol.
La contagion se produit par ingestion d’eau ou de nourriture contaminée par les fèces contenant les kystes qui, lorsqu’ils atteignent l’intestin du nouvel hôte, se transforment en trophozoïte, c’est-à-dire en amibe active capable de se multiplier et envahir la muqueuse. L’amibiase est un exemple typique d’infection par contagion fécale, décrite par les anglophones comme “Cycle F” : feces, fingers, flies, food (pour fèces, doigts, mouches, nourriture). Les parasites présents dans les selles atteignent la nourriture par les mains ou les mouches. De nombreuses anecdotes sont signalées sur des cas de contagion multiple, parmi lesquels celui d’un cuisinier d’un navire de croisière qui, en accordant peu d’attention à l’hygiène de ses mains, aurait infecté tous les passagers ! (Nous rappelons que dans les pays anglo-saxons, dans les toilettes publiques, sont affichés des avis “Maintenant lavez-vous les mains !”).
Au genre Entamoeba appartiennent de nombreuses espèces, dont certaines, comme Entamoeba histolytica, Entamoeba dispar, Entamoeba moshkovskii, Entamoeba polecki, Entamoeba coli, et Entamoeba hartmanni peuvent vivre dans l’intestin humain. Seule Entamoeba histolytica est sûrement pathogène. Le diagnostic différentiel est basé sur les caractéristiques du kyste, tétranucléaire dans Entamoeba histolytica, et principalement sur les méthodes immunologiques ou de biologie moléculaire.
L’amibe dans la culture populaire
Dans la chanson “A very cellular song” (“une chanson très cellulaire”) de “The incredible string band”, la vie est décrite du point de vue d’une amibe : “Amoebas are very small, There’s absolutely no strife Living the timeless life, I don’t need a wife Living the timeless life. If I need a friend, I just give a wriggle split right down the middle and when I look there’s two of me both as handsome as can be. Oh, here we go slithering, here we go slithering and squelching on …”
(“Les amibes sont très petites, Il n’y a absolument pas de lutte Vivant la vie éternelle, Je n’ai pas besoin d’une femme, Vivant la vie éternelle. Si j’ai besoin d’un ami, je me divise en deux et quand je regarde, je vois deux moi, tous deux aussi beaux qu’il n’est possible. Nous allons, ondulant et pataugeant…. “).
Synonymes
Volvox proteus Pallas, 1766; Proteus diffluens O.F. Müller, 1786; Chaos diffluens (O.F. Müller, 1786) Schaeffer, 1926.
